Chlorid joditý
| Chlorid joditý | |
|---|---|
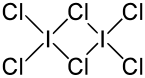 Struktura dimerního chloridu joditého | |
 Ampule s chloridem joditým | |
| Obecné | |
| Systematický název | Chlorid joditý |
| Anglický název | Iodine trichloride |
| Německý název | Iodtrichlorid |
| Sumární vzorec | I2Cl6 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 865-44-1 |
| PubChem | 70076 |
| SMILES | ClI(Cl)Cl |
| InChI | InChI=1S/Cl3I/c1-4(2)3 |
| Vlastnosti | |
| Molární hmotnost | 466,5281 g/mol |
| Teplota tání | 63 °C |
| Hustota | 3,11 g·cm−3 |
| Bezpečnost | |
 GHS03  GHS05 Nebezpečí[1] | |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Chlorid joditý je interhalogen, v pevném stavu vytváří dimerní molekuly I2Cl6. Dimer se skládá ze čtyř terminálních a dvou můstkových atomů chloru, strukturu lze popsat vzorcem Cl2I(µ-Cl)2ICl2.
Lze jej připravit reakcí jodu s nadbytkem kapalného chloru při teplotě −70 °C. V tavenině je vodivý, což lze vysvětlit existencí disociace:[2]
- I2Cl6 ↔ ICl +
2 + ICl -
4
Existence této rovnováhy byla potvrzena i strukturou některých solí, např. K[ICl2]·H2O nebo [ICl2][AlCl4].[2]
Je to silné chlorační[2] a oxidační činidlo, při kontaktu s organickým materiálem může vzplanout.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Iodine trichloride na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons
| Chloridy s prvkem v oxidačním čísle III. | |
|---|---|
| Chlorid aktinitý (AcCl3) • Chlorid hlinitý (AlCl3) • Chlorid americitý (AmCl3) • Chlorid arsenitý (AsCl3) • Chlorid zlatitý (AuCl3) • Chlorid boritý (BCl3) • Chlorid bismutitý (BiCl3) • Chlorid berkelitý (BkCl3) • Chlorid ceritý (CeCl3) • Chlorid kalifornitý (CfCl3) • Chlorid curitý (CmCl3) • Chlorid kobaltitý (CoCl3) • Chlorid chromitý (CrCl3) • Chlorid dysprositý (DyCl3) • Chlorid erbitý (ErCl3) • Chlorid einsteinitý (EsCl3) • Chlorid europitý (EuCl3) • Chlorid železitý (FeCl3) • Chlorid gallitý (GaCl3) • Chlorid gadolinitý (GdCl3) • Chlorid holmitý (HoCl3) • Chlorid joditý (I2Cl6) • Chlorid inditý (InCl3) • Chlorid iriditý (IrCl3) • Chlorid lanthanitý (LaCl3) • Chlorid lawrencitý (LrCl3) • Chlorid lutecitý (LuCl3) • Chlorid manganitý (MnCl3) • Chlorid molybdenitý (MoCl3) • Chlorid dusitý (NCl3) • Chlorid niobitý (NbCl3) • Chlorid neodymitý (NdCl3) • Chlorid niklitý (NiCl3) • Chlorid neptunitý (NpCl3) • Chlorid osmitý (OsCl3) • Chlorid fosforitý (PCl3) • Chlorid promethitý (PmCl3) • Chlorid praseodymitý (PrCl3) • Chlorid plutonitý (PuCl3) • Chlorid rhenitý (ReCl3) • Chlorid rhoditý (RhCl3) • Chlorid ruthenitý (RuCl3) • Chlorid antimonitý (SbCl3) • Chlorid skanditý (ScCl3) • Chlorid samaritý (SmCl3) • Chlorid tantalitý (TaCl3) • Chlorid terbitý (TbCl3) • Chlorid technecitý (TcCl3) • Chlorid thoritý (ThCl3) • Chlorid titanitý (TiCl3) • Chlorid thallitý (TlCl3) • Chlorid thulitý (TmCl3) • Chlorid uranitý (UCl3) • Chlorid vanaditý (VCl3) • Chlorid wolframitý (WCl3) • Chlorid yttritý (YCl3) • Chlorid ytterbitý (YbCl3) • Chlorid zirkonitý (ZrCl3) | |
| Interhalogeny | |
|---|---|
| Fluoridy | fluorid bromný (BrF) • fluorid bromitý (BrF3) • fluorid bromičný (BrF5) • fluorid chlorný (ClF) • fluorid chloritý (ClF3) • fluorid chlorečný (ClF5) • fluorid jodný (IF) • fluorid joditý (IF3) • fluorid jodičný (IF5) • fluorid jodistý (IF7) |
| Chloridy | |
| Bromidy | |
| Jodidy | |
Portály: Chemie








