Titik kritis (termodinamika)

Dalam termodinamika, titik kritis adalah titik akhir kurva kesetimbangan fasa. Contoh yang paling umum adalah titik kritis uap-cair, titik akhir kurva suhu-tekanan yang menunjukkan kondisi dimana fasa uap dan cair dapat bersama. Pada titik kritis, didefinisikan dengan temperatur kritis Tc dan tekanan kritis pc, batas-batas fasa akan hilang.
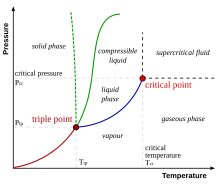
Pada saat mendekati temperatur titik kritis, properti gas dan cairan menjadi sama, fase ini disebut Fluida superkritikal. Di atas titik kritis cairan tidak dapat terbentuk dengan menambah tekanan, tetapi dengan menambah tekanan yang cukup bahan padat bisa terbentuk. Tekanan kritis adalah tekanan uap pada titik kritis. Untuk diagram yang menunjukkan properti termodinamika sebuah bahan, titik di mana temperatur kritis dan tekanan kritis bertemu dinamai Titik kritis dari bahan itu. Molar kritis adalah volume dari satu mol sebuah bahan pada suhu kritis dan tekanan kritis.
Definisi matematika
Pada sebuah bahan murni, terdapat titik infleksi pada isoterm kritis di sebuah diagram pV. Ini berarti pada titik kritis:
Relasi ini bisa dipakai untuk mengevaluasi dua parameter dari persamaan fase menurut sifat kritisnya.
Kadang-kadang persamaan dapat disederhanakan menjadi kira-kira:
prinsip fase yang bersangkutan menunjukkan bahwa substansi tersebut pada tekanan dan suhu yang telah dikurangi dengan ekuivalen mempunyai volume yang ekuivalen. Persamaan ini kira-kira relevan untuk beberapa substansi, tetapi menjadi sangat tidak akurat untuk pr berharga tinggi.
Tabel titik kritis dari beberapa bahan
| Substansi[2][3] | Suhu kritis (°C) | Suhu kritis (K) | Tekanan kritis (atm) | Tekanan kritis (MPa) |
|---|---|---|---|---|
| Argon | −122.4 | 150.8 | 48.1 | 4.870 |
| Ammonia[1] | 132.4 | 405.6 | 111.3 | 11.28 |
| Bromin | 310.8 | 584 | 102 | 10.340 |
| Klorin | 143.8 | 417 | 76.0 | 7.700 |
| Fluorin | −128.85 | 144.3 | 51.5 | 5.220 |
| Helium | −267.96 | 5.19 | 2.24 | 0.227 |
| Hidrogen | −239.95 | 33.2 | 12.8 | 1.297 |
| Kripton | −63.8 | 209.4 | 54.3 | 5.500 |
| Neon | −228.75 | 44.4 | 27.2 | 2.760 |
| Nitrogen | −146.9 | 126.2 | 33.5 | 3.390 |
| Oksigen | −118.6 | 154.6 | 49.8 | 5.050 |
| CO2 | 31.04 | 304.1 | 72.8 | 7.377 |
| H2SO4 | 654 | 927 | 45.4 | 4.6 |
| Xenon | 16.6 | 289.7 | 57.6 | 5.840 |
| Lithium | 2,950 | 3,223 | 65.2 | 6.700 |
| Raksa | 1,476.9 | 1,750 | 1,587 | 172 |
| Besi | 8,227 | 8,500 | ||
| Emas | 6,977 | 7,250 | 5000 | 530 |
| Aluminium | 7,577 | 7,850 | ||
| Wolfram | 15,227 | 15,500 | ||
| Udara[4][5] | 373.946 | 647.096 | 217.7 | 22.059 |
Bacaan lebih lanjut
- "Critical Temperature and Pressure" (HTML). Department of Chemistry. Purdue University. Diakses tanggal 2006-12-03.
- Hagen Kleinert and Verena Schulte-Frohlinde, Critical Properties of φ4-Theories, World Scientific (Singapur, 2001) Diarsipkan 2008-02-26 di Wayback Machine.; Paperback ISBN 981-02-4658-7 (baca online here)
Referensi
- ^ Horstmann, Sven (2000) (dalam bahasa de). Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung (Tesis Ph.D.). Carl-von-Ossietzky Universität Oldenburg. ISBN 3-8265-7829-5.
- ^ Emsley, John (1991). The Elements (edisi ke-(Second Edition)). Oxford University Press. ISBN 0-19-855818-X.
- ^ Thermodynamics: An Engineering Approach (edisi ke-(Fourth Edition)). McGraw-Hill. 2001. hlm. 824. ISBN 0-07-238332-1. Parameter
|coauthors=yang tidak diketahui mengabaikan (|author=yang disarankan) (bantuan) - ^ "Release on the IAPWS Industrial Formulation 1997 for the Thermodynamic Properties of Water and Steam". Erlangen, Germany. International Association for the Properties of Water and Steam. September 1997. Diarsipkan dari versi asli (PDF) tanggal 2018-12-25. Diakses tanggal 2006-12-03.
- ^ "Critical Temperature and Pressure". Purdue University. Diakses tanggal 2006-12-19.
- "Revised Release on the IAPWS Industrial Formulation 1997 for the Thermodynamic Properties of Water and Steam" (PDF). International Association for the Properties of Water and Steam. August 2007. Diakses tanggal 2009-06-09.
Pranala luar
- "Critical points for some common solvents". ProSciTech. Diarsipkan dari versi asli tanggal 2008-01-31. Diakses tanggal 2016-02-07.
- "Critical Temperature and Pressure". Department of Chemistry. Purdue University. Diakses tanggal 2006-12-03.













