Difluoroammina
| Difluoroammina | |
|---|---|
 | |
| Caratteristiche generali | |
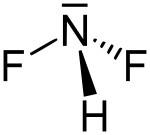
| Formula bruta o molecolare | F2HN |
| Aspetto | gas incolore |
| Numero CAS | 10405-27-3 |
| PubChem | 25242 |
| SMILES | N(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,424[1] |
| Temperatura di fusione | −116,4 °C (157 K)[2] |
| Temperatura di ebollizione | −23,6 °C (250 K)[2] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -67[2] |
| Indicazioni di sicurezza | |
| Frasi H | --[3] |
| Modifica dati su Wikidata · Manuale | |
La difluoroammina è il composto inorganico con formula NHF2. Questo alogenuro di azoto in condizioni normali è un gas incolore fortemente reattivo. È un composto instabile che può esplodere facilmente.[2][4]
Storia
Una sostanza ritenuta difluoroammina fu descritta da Ruff e Staub nel 1931,[5] ma i tentativi successivi di riprodurre la sintesi fallirono, e le proprietà fisiche riportate da Ruff non sono in accordo con quelle attuali.[1] La difluoroammina fu sintetizzata e caratterizzata con certezza per la prima volta nel 1959 da Al Kennedy e Charles B. Colburn,[6] isolandola in piccola quantità come sottoprodotto dalla reazione a 250-300 ºC tra trifluoruro di azoto e arsenico.
Sintesi
La difluoroammina si può sintetizzare con una resa del 74% scaldando sotto vuoto una miscela di tetrafluoroidrazina e tiofenolo, con successiva distillazione sotto vuoto. La reazione complessiva risulta:[7]
Alternativamente si può fluorurare l'urea e idrolizzare il difluoruro di urea formato:[8]
Reattività[2][4]
La difluoroammina si decompone termicamente formando N2F2 in presenza di KF (che assorbe HF rilasciato):
La reazione a bassa temperatura con ClF produce clorodifluoroammina:
NHF2 è una base debole e può formare addotti reagendo a -80 ºC con acidi di Lewis come BF3, PF5 e SO2; aumentando la temperatura questi addotti si decompongono prima di arrivare a temperatura ambiente. Sotto i -80 ºC reagisce con AsF5 in HF anidro formando NH2F+2 e AsF−6.
La difluoroammina può reagire anche come acido:
se non ci sono basi disponibili, l'anione NF−2 reagisce formando N2F2:
In chimica organica la difluoroammina viene talvolta usata per ottenere difluoroammino derivati di composti organici.
Note
- ^ a b Lawton e Weber 1959
- ^ a b c d e Holleman e Wiberg 2007
- ^ Questa sostanza non è stata ancora classificata in termini di pericolosità o non è stata ancora trovata una fonte affidabile e citabile.
- ^ a b Hammerl e Klapötke 2006
- ^ Ruff e Staub 1931
- ^ Kennedy e Colburn 1959
- ^ Freeman et al. 1960
- ^ Parker et al. 1970
Bibliografia
- (EN) J. P. Freeman, A. Kennedy e C. B. Colburn, The Direct Synthesis of Difluoramine, in J. Am. Chem. Soc., vol. 82, n. 20, 1960, pp. 5304-5305, DOI:10.1021/ja01505a009.
- (EN) A. Hammerl e T. M. Klapötke, Nitrogen: Inorganic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia157, ISBN 9780470862100.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) A. Kennedy e C. B. Colburn, Difluoroamine, in J. Am. Chem. Soc., vol. 81, n. 11, 1959, pp. 2906-2907, DOI:10.1021/ja01520a072.
- (EN) E. A. Lawton e J. Q. Weber, The direct fluorination of urea: the synthesis and properties of difluoramine, in J. Am. Chem. Soc., vol. 81, n. 17, 1959, p. 4755, DOI:10.1021/ja01526a087.
- (EN) C. O. Parker, J. P. Freman, W. Graham e M. Lustig, 1,1‐Difluorourea Solutions and Difluoroamine–Extra‐Hazardous Materials, in Inorg. Synth., vol. 12, 1970, pp. 307-312, DOI:10.1002/9780470132432.ch55.
- (DE) O. Ruff e L. Staub, Stickstofffluoride und ihre Bildungsbedingungen, in Z. anorg. allgem. Chem., vol. 198, n. 1, 1931, pp. 32-38, DOI:10.1002/zaac.19311980103.
V · D · M | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fluoruri inorganici |
| ||||||||||||||||
| Organofluoruri | Aloperidolo · Bicalutamide · Desflurano · Desossimetasone · 1,2-dicloro-1,2-difluoroetene · Diclorodifluorometano · 1,2-diclorotetrafluoroetano · 1,2-dicloro-1-(trifluorometossi)-1,2,2-trifluoroetano · 1,1-difluoro-1-cloro-etano · Difluprednato · Doxefazepam · Droperidolo · Eptafluoropropano · Esafluoro-1,3-butadiene · Esafluoro-2-propanolo · FGIN-127 · Fipronil · 1-fluoro-2,4-dinitrobenzene · Fluorobenzene · Fluorofosgene · Fluorometano · Fluoruro di vinilidene · Fluoximesterone · Flupirtina · Lufenuron · Metossiflurano · Monoclorodifluorometano · Niaprazina · Nitisinone · Perfluoropropene · Perfluoroesano · Perfluoroisobutene · Perfluorononanoato di ammonio · Piriprolo · Riluzolo · Ritanserina · Seletracetam · Tegafur · Telcagepant · 1,2,3,4-tetracloro-esafluorobutano · 1,1,1,2-tetrafluoroetano · Tetrafluoroetene · Tetrafluorometano · Travoprost · 1,1,2-tricloro-1-fluoroetano · Triclorofluorometano · 1,1,2-triclorotrifluoroetano · 2-cloro-1,1,1-trifluoroetano · Trifluorometano · 2,4,6-tris(perfluorofenil)-1,3,5-triazina · Zolazepam | ||||||||||||||||
| Classi di fluoruri | Fluorocarburi · Idrofluoroeteri · Interalogeni | ||||||||||||||||
| Processi di sintesi | Fluorurazione elettrochimica | ||||||||||||||||
| Miscele | Acido magico · R-410A | ||||||||||||||||
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia


![{\displaystyle {\ce {2NHF2 ->[{\ce {(KF)}}] N2F2 + 2HF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/207e0fc8c5d543d1040cd1fe90f2b9f57fc3dffa)













