ヨードメタン
| ヨードメタン | |
|---|---|
 | |
 |  |
ヨードメタン | |
別称 ヨウ化メチル, モノヨードメタン, MeI, ハロン10001, UN 2644 | |
| 識別情報 | |
| CAS登録番号 | 74-88-4  |
| PubChem | 6328 |
| EC番号 | 200-819-5 |
| KEGG | C18448 |
| RTECS番号 | PA9450000 |
| |
| |
| 特性 | |
| 化学式 | CH3I |
| モル質量 | 141.94 g/mol |
| 外観 | 刺激臭を持つ無色透明の液体 |
| 密度 | 2.2789 g/cm3 (20 °C) |
| 融点 | -66.45 °C (206.70 K) |
| 沸点 | 42.43 °C (315.58 K) |
| 水への溶解度 | 1.4 g/100 mL (20 °C) |
| log POW | 1.51 |
| 蒸気圧 | 50 kPa at 20 °C 53.32 at 25.3 °C 166.1 kPa at 55 °C |
| 屈折率 (nD) | 1.531 |
| 構造 | |
| 分子の形 | Tetrahedral |
| 危険性 | |
| 安全データシート(外部リンク) | MSDS at Oxford University |
| EU分類 | 毒性(T), 発癌性 |
| NFPA 704 |  1 3 1 |
| Rフレーズ | R21, R23/25, R37/38, R40 |
| Sフレーズ | (S1/2), S36/37, S38, S45 |
| 爆発限界 | 8.5 - 66% |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ヨードメタン(英: iodomethane)は、分子式 CH3I で表される有機化合物である。別名、ヨウ化メチル(英: Methyl Iodide)ともいう。常温で無色透明の液体で、エタノール、ジエチルエーテルに任意の割合で溶ける。空気中で一部が光により分解し薄い紫色を帯びることがあるため、褐色ビンを用いて暗所保存する。その際には銅を安定化剤として用いる場合がある。有機合成化学においてはメチル化剤として良く用いられ、SN2反応によりメチル基を付加することが多い。毒性が高い。
性質
SN2反応でメチル化剤として非常に良く用いられる反応試薬である。例として、フェノールやカルボン酸のメチル化が挙げられる。
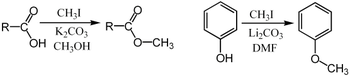
この2つの例では塩基(炭酸カリウムや炭酸リチウム)がプロトンを捕捉しアニオンを生成させることで、SN2反応における求核剤を供給している。
HSAB則に従うと、ヨウ素は「ソフト」な脱離基であるため、最終生成物は「ソフト」な求核剤と結合したものであることが多い。例えばチオシアネートイオン(SCN−) は「ハード」な窒素Nと「ソフト」の硫黄Sを併せ持つが、このチオシアネートとヨードメタンとを反応させると、メチルチオシアナート (CH3SCN) が主生成物となり、メチルイソチオシアナート (CH3NCS) が副生成物となる。HSAB則はエノラート(1,3-ジカルボニル化合物の誘導体など)をメチル化させる際には重要となる。エノラートをヨードメタンでメチル化させる際には、「ハード」な酸素よりも「ソフト」な炭素を好んで攻撃するということになる。即ちヨードメタンを用いると、他の原子のメチル化より炭素のメチル化が優先して進行しやすいという傾向がある。
またグリニャール試薬であるMeMgIの前駆体となる。モンサント法ではヨードメタンがロジウム錯体と反応し、ヨウ化アセチルを生成する。
製法
赤リンとメタノールの混合物にヨウ素を反応させると、発熱反応によりヨードメタンが生成する。これはヨウ化剤である三ヨウ化リンがin situで生成するためである。
反応混合物を蒸留し、チオ硫酸ナトリウム水溶液(ヨウ素の除去)と炭酸ナトリウム水溶液(リン酸の除去)で洗浄し、乾燥後に再度蒸留すると目的物が得られる。またシリカゲルカラムクロマトグラフィーやアルミナカラムクロマトグラフィーにより精製する方法もある。
他にも、炭酸カルシウムを加えたヨウ化カリウム水溶液中へ硫酸ジメチルを加えることでも得ることができる。
どちらの反応を用いても高い収率でヨードメタンが得られる。
メチル化剤としてのヨードメタン
メチル化剤として非常に多用されるが、欠点も存在する。等物質量のヨードメタンとクロロメタンとを比較すると、ヨードメタンの方が2倍の重量となってしまう。しかしながらクロロメタンが気体であるのに対しヨードメタンは液体であるため、比較的扱いやすい。またメチル化の能力自体も、ヨードメタンの方が優れている。また一般にヨウ化物は対応する塩化物や臭化物と比較すると高価であるが、ヨードメタンは安価である。
脱離基のヨウ素原子は脱離と同時に求核剤となるため、副反応の原因となる。ヨードメタンのメチル化の能力は非常に高く、塩化メチルや臭化メチルと比較してもより危険である。しかし代替化合物を選択しようとする場合は、コスト、取り扱いの容易さ、危険性、選択性、精製の容易さなどを考慮に入れる必要がある。
安全性
動物実験により変異原性があることが確認されている。ヒトに対する発がん性については、国際がん研究機関(IARC)によるリスク分類でグループ3、すなわち分類できない(不明である)とされている。
ヒトに対する刺激性が高く、経口・経皮接触・吸入などにより、呼吸器や中枢神経系などに障害が起こりうる。このため取り扱う際にはドラフトを用いるべきである。日本では毒物及び劇物取締法により劇物に指定されている。また、労働安全衛生法の第2類特定化学物質に指定されている。
関連項目
参考文献
- March, J. (1992). Advanced Organic Chemistry (4th Edn.), New York:Wiley. ISBN 0-471-60180-2
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
| |
|---|---|
| 一置換体 | CH3F · CH3Cl · CH3Br · CH3I |
| 二置換体 | CH2F2 · CH2ClF · CH2BrF · CH2FI · CH2Cl2 · CH2BrCl · CH2ClI · CH2Br2 · CH2BrI · CH2I2 |
| 三置換体 | CHF3 · CHClF2 · CHBrF2 · CHF2I · CHCl2F · C*HBrClF · C*HClFI · CHBr2F · C*HBrFI · CHFI2 · CHCl3 · CHBrCl2 · CHCl2I · CHBr2Cl · C*HBrClI · CHClI2 · CHBr3 · CHBr2I · CHBrI2 · CHI3 |
| 四置換体 | CF4 · CClF3 · CBrF3 · CF3I · CCl2F2 · CBrClF2 · CClF2I · CBr2F2 · CBrF2I · CF2I2 · CCl3F · CBrCl2F · CCl2FI · CBr2ClF · C*BrClFI · CClFI2 · CBr3F · CBr2FI · CBrFI2 · CFI3 · CCl4 · CBrCl3 · CCl3I · CBr2Cl2 · CBrCl2I · CCl2I2 · CBr3Cl · CBr2ClI · CBrClI2 · CClI3 · CBr4 · CBr3I · CBr2I2 · CBrI3 · CI4 |
| * 記号はキラル化合物 | |
- 表示
- 編集








