Azotyny
 | Ten artykuł od 2012-05 zawiera treści, przy których brakuje odnośników do źródeł. Należy dodać przypisy do treści niemających odnośników do źródeł. Dodanie listy źródeł bibliograficznych jest problematyczne, ponieważ nie wiadomo, które treści one uźródławiają. Sprawdź w źródłach: Encyklopedia PWN • Google Books • Google Scholar • Federacja Bibliotek Cyfrowych • BazHum • BazTech • RCIN • Internet Archive (texts / inlibrary) Dokładniejsze informacje o tym, co należy poprawić, być może znajdują się w dyskusji tego artykułu. Po wyeliminowaniu niedoskonałości należy usunąć szablon {{Dopracować}} z tego artykułu. |
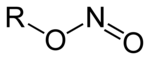
Azotyny, nazwa Stocka: azotany(III) – grupa związków chemicznych, soli lub estrów kwasu azotawego.
Budowa azotynów

2. Na obu atomach tlenu występują częściowe ładunki ujemne
Wszystkie azotyny zawierają jon NO−
2. Jon ten jest izoelektronowy (ma tę samą liczbę elektronów i ich rozmieszczenie) z cząsteczką ozonu. Od anionu NO−
3 występującego w azotanach różni się tym, że trzeci ze zhybrydyzowanych orbitali sp² nie tworzy wiązania z atomem tlenu – zostaje zajęty przez niewiążącą parę elektronową. Obydwa wiązania N−O są równocenne, a cząsteczka ma kształt trójkąta równoramiennego. Budowę jonu azotynowego opisać też można za pomocą struktur rezonansowych:

W wyniku przyjęcia przez jon NO−
2 kationu (np. wodoru czy metalu), na utworzenie wiązania jest zużywana jedna z niewiążących par elektronowych któregoś z atomów tlenu. W przypadku reakcji jonu NO−
2 np. z atomem węgla powstają zarówno estry kwasu azotawego, jak i związki nitrowe.
Właściwości
Nieorganiczne azotyny są substancjami krystalicznymi. Rozpuszczają się w wodzie. Mogą wykazywać zarówno właściwości redukujące, np. wobec nadmanganianu potasu w kwaśnym środowisku:
- 2KMnO
4 + 5KNO
2 + 3H
2SO
4 → 2MnSO
4 + 5KNO
3 + K
2SO
4 + 3H
2O
czyli jonowo:
- 2MnO−
4 + 5NO−
2 + 6H+
→ 2Mn2+
+ 5NO−
3 + 3H
2O
jak i utleniające, np. wobec wodorków niemetali.
Azotyny nieorganiczne reagują w środowisku kwaśnym z pierwszorzędowymi aminami aromatycznymi. Reakcja ta nosi nazwę diazowania, a w jej wyniku powstają nietrwałe sole diazoniowe, które zwykle od razu poddaje się dalszym reakcjom, np. [1]:

Synteza chlorku m-trifluorometylobenzenosulfonowego poprzez związek diazoniowy
Do wykrywania azotynów, można wykorzystać odczynnik Griessa. Metoda ta pozwala także na oznaczanie azotanów po ich wstępnej redukcji do azotynów[2].
Otrzymywanie
Azotyny nieorganiczne można otrzymać przez wprowadzenie mieszaniny tlenku azotu i dwutlenku azotu do roztworów wodorotlenków lub węglanów metali alkalicznych, np.
- 2NaOH + NO + NO
2 → 2NaNO
2 + H
2O
Inną metodą jest redukcja stopionych azotanów metalicznym ołowiem, np.
- NaNO
3 + Pb → NaNO
2 + PbO
Niektóre azotany redukują się do azotynów w wyniku podgrzania, np.
- 2KNO
3 → 2KNO
2 + O
2
Wpływ na zdrowie
Azotyny (także azotany) są znanymi konserwantami stosowanymi dla zmniejszenia ryzyka ich przedawkowania w mieszaninie z solą kuchenną. Azotyny i azotany pomagają chronić wyroby mięsne przed zepsuciem. Według polskiej normy w wyrobach mięsnych maksymalne stężenie dodatku konserwującego (E249, E250, E251, E252) zostało ustalone na 150 mg/kg, a w produktach mięsnych sterylizowanych (konserwach) – 100 mg/kg[3][4]. Peklowane mięsne produkty tradycyjne mogą zawierać 180 mg/kg[5][6]. Według Światowej Organizacji Zdrowia dopuszczalne dzienne spożycie (ADI) wynosi 0 – 0,1 mg/kilogram masy ciała/dzień[7].
- Regularne spożywanie azotanów i azotynów większa ryzyko rozwoju nowotworów. Codzienne spożywanie 50 g mięsa przetworzonego zwiększa ryzyko zachorowania na raka jelita grubego o 18%[8][9].
- Na szkodliwe działanie azotynów i azotanów najbardziej narażone są małe dzieci, kobiety w ciąży, osoby przewlekle chore i starsze[7].
- Azotyny i azotany obniżają wartość odżywcza pokarmów i wchłanianie witaminy A i witamin z grupy B[10].
Ważniejsze azotyny
Zobacz też
Przypisy
- ↑ R.V.R.V. Hoffman R.V.R.V., m-Trifluoromethylbenzenesulfonyl Chloride, „Organic Syntheses”, 60, 1981, s. 121, DOI: 10.15227/orgsyn.060.0121 .
- ↑ Donald L.D.L. Granger Donald L.D.L. i inni, Measurement of nitrate and nitrite in biological samples using nitrate reductase and Griess reaction, „Methods in Enzymology”, 268, 1996, s. 142–151, DOI: 10.1016/S0076-6879(96)68016-1 .
- ↑ L_2018118PL.01000701.xml [online], eur-lex.europa.eu [dostęp 2019-10-18] .
- ↑ Publications Office of the EuropeanP.O.t. E. Union Publications Office of the EuropeanP.O.t. E., C/2015/3526, Decyzja Komisji (UE) 2015/826 z dnia 22 maja 2015 r. dotycząca przepisów krajowych zgłoszonych przez Danię w sprawie dodawania azotynów do niektórych produktów mięsnych (notyfikowana jako dokument nr C(2015) 3526) [online], op.europa.eu, 22 maja 2015 [dostęp 2019-10-18] (ang.).
- ↑ „Mięso i Wędliny nr 6/2006” .
- ↑ Nowe przepisy dotyczące azotynów i azotanów [online], www.wedlinydomowe.pl [dostęp 2019-10-18] .
- ↑ a b MałgorzataM. Wilkowska MałgorzataM., e250 – Azotyn Sodu [online], Dietetycy.org.pl, 2 listopada 2018 [dostęp 2019-10-18] (pol.).
- ↑ Raphaëlle L.R.L. Santarelli Raphaëlle L.R.L., FabriceF. Pierre FabriceF., Denis E.D.E. Corpet Denis E.D.E., Processed meat and colorectal cancer: a review of epidemiologic and experimental evidence, „Nutrition and Cancer”, 60 (2), 2008, s. 131–144, DOI: 10.1080/01635580701684872, ISSN 0163-5581, PMID: 18444144, PMCID: PMC2661797 [dostęp 2019-10-18] .
- ↑ Spożycie mięsa a ryzyko nowotworów Narodowe Centrum Edukacji Żywieniowej [online], ncez.pl [dostęp 2019-10-18] .
- ↑ M.M. Lhuissier M.M., M.M. Suschetet M.M., J.J. Causeret J.J., [Effect of nitrites and nitrates on various aspects of vitamin nutritional status], „Annales De La Nutrition Et De L’alimentation”, 30 (5–6), 1976, s. 847–858, ISSN 0003-4037, PMID: 20023 [dostęp 2019-10-18] .










