Dioxid de siliciu
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |
| Dioxid de siliciu | |
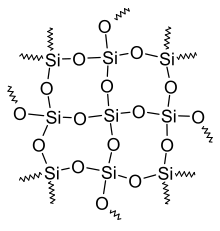 SiO2 nu este moleculă, ci formula chimică a unei grupe de polimeri anorganici, la fiecare atom-Si fiind legați 4 atomi de oxigen. | |
 | |
| Nume IUPAC | Dioxid de siliciu |
|---|---|
| Alte denumiri | Oxid de siliciu silicat Aerosil |
| Identificare | |
SMILES O=[Si]=O[1]  | |
| Număr CAS | diferit, ex. . 7631-86-9, 112945-52-5, 112926-00-8, 14808-60-7 |
| ChEMBL | CHEMBL3188292 |
| PubChem CID | 24261 |
| Informații generale | |
| Formulă chimică | SiO2 |
| Masă molară | 60,1 g/mol |
| Proprietăți | |
| Densitate | 1,9 - 4,29 g/cm³, frecvent 2,2 (amorf) până la 2,65 (cristalin) g/cm³ |
| Starea de agregare | solidă |
| Punct de topire | 1723 °C |
| Punct de fierbere | 2230 °C |
| Duritate (Scara Mohs) | 4 - 10 MV/cm (depinde de modul de producere. ex la o oxidație umedă 4 - 6 MV/cm valoare mai ridicată la oxidare uscată.) |
| Presiune de vapori | 0 millimetre of mercury  |
| Fraze S | S22 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
Modifică date / text  | |
Dioxidul de siliciu este denumirea grupei reprezentate prin formula chimică SiO2 fiind confundat de unii cu acidul silicic H4SiO4 sau denumit incorect oxid de siliciu. Dioxidul de siliciu este partea componentă cea mai importantă a sticlei și a silicaților, a căror formă cea mai reprezentativă este cuarțul.
Varietăți în mineralogie și mod de răspândire
Formele amorfe de SiO2 sunt răspândite frecvent în stare de amestec ca în lava vulcanică sticloasă și tectite (topituri sticloase provenind din meteoriți), exemple de varietăți neomogene de dioxid de siliciu:
- de natură biogenă: schelete de radiolari, diatomee, bureți de mare ca incluziuni din opal sau diferite roci
- Geyserit: produse amorfe provenite din Geysere
- Tahylit: sticlă vulcanică de natură bazaltică care pe lângă SiO2 conțin cantități mari de FeO, MgO, CaO și Al2O3.
- Obsidian: sticlă vulcanică, de natură granitică
- Lechatelierit: sticlă naturală ca și tectitele cu deosebirea că nu se formează prin căderea meteoriților ci prin acțiunea fulgerului când trăsnetul se descarcă în nisipuri de cuarț se formează fulguritul.
- Opalul e la fel un mineral bogat în SiO2
- SiO2 are punctul de topire de peste 1727 °C (la o presiune de 1 bar)
Formele cristaline de SiO2 spre deosebire de formele amorfe, formele cristaline au toleranță mult mai mică față de impurități, deosebindu-se astfel numai prin structură:
- Morganit (Calcedon) o varitate de cuarț fibros, microcristalin
- α-Quarz (cuarț de adâncime format la temperaturi < 573 °C și presiuni de p < 30 kbar)
- Tridymit (o variantă de cuarț format la temperaturi mai ridicate) 867 °C < 1470 °C, p < 5 kbar
- Cristobalit (o variantă de cuarț format la temperaturi mai ridicate) 1470 °C < 1727 °C
- Coesit:(variantă a cuarț) cu densitatea 3,01 g/cm³, format la 20 kbar < p < 75 kbar
- Stishovit: (silicat din clasa oxizilor metalici) 75 kbar < p < ? kbar
Dioxidul de siliciu face parte din silicați în grupa cărora cuarțul este într-o stare aproape pură, sau legată de alte elemente ca în cazul: feldspatului mineralelor argiloase, siliciul fiind o parte componentă importantă a scoarței pământului.
Proprietăți chimice
Dioxidul de siliciu este practic insolubil în apă sau acizi cu excepția acidului fluorhidric (HF) reacție în care se eliberează tetrafluoridul de siliciu (gaz) având formula (SiF4). Iar mai ales forma amorfă a dioxidului de siliciu se dizolvă în alcali (baze).
Producere pe cale sintetică
- În mod sintetic este produs în cantități mari mai ales forma amorfă, din nisipuri bogate în cuarț care se dizolvă în soluție alcalină de carbonat de potasiu
- O altă metodă de producere a lui este procedeul pirogen din soluție de tetraclorură de siliciu (SiCl4)
Utilizare
Dioxidul de siliciu sintetic este folosit în fabricarea de vopsele, lacuri, substanțelor adezive, obiecte de artă, industria semiconductorilor sau ca pigment în producerea straturilor speciale aplicate pe hârtie.
Este utilizat de asemenea în industria cosmetică, alimentară (ex.purificarea berii, agent antiaglomerant pentru cafeaua instant), farmaceutică, producerii detergenților.
Ca material izolant, sau la ambalaje ca material de protecție a obiectelor fragile, în fabricarea cauciucului.
O importanță mare o are în industria sticlei, lentilelor aparatelor optice, ca izolant electric, în laboratoare sticla de cuarț fiind aproape indispensabilă, sau sticle speciale ca cele rezistente la temperaturi ridicate (sticla de iena), sau care filtrează radiațiile ultraviolete.
Este folosit în fabricarea anvelopelor de iarnă pentru a evita întărirea cauciucului în condiții de frig.[2]
Note
Vezi și
| ||||||||||||||||||||||||||||||||||||||











