Acido trifluorometansolfonico
| Acido trifluorometansolfonico | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| acido triflico, acido perfluorometansolfonico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CF3SO3H |
| Massa molecolare (u) | 150,08 |
| Aspetto | liquido incolore |
| Numero CAS | 1493-13-6 |
| Numero EINECS | 216-087-5 |
| PubChem | 62406 e 71773376 |
| SMILES | C(F)(F)(F)S(=O)(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,70 |
| Solubilità in acqua | completamente miscibile |
| Temperatura di fusione | –40 °C (233 K) |
| Temperatura di ebollizione | 162 °C (435 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1605 ratto, orale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  | |
| Frasi H | 302, 331, 314 |
| Consigli P | 260, 303+361+353, 305+351+338, 301+330+331, 405, 501 |
| Modifica dati su Wikidata · Manuale | |
L'acido trifluorometansolfonico, noto anche con il nome comune di acido triflico, abbreviato come HOTf, è un acido solfonico di formula CF3SO3H. In condizioni normali è un liquido incolore di odore pungente, miscibile con l'acqua in tutte le proporzioni. È un acido molto forte, usato soprattutto nell'ambito della ricerca come catalizzatore e precursore in chimica organica.[1][2]
Storia
L'acido triflico fu preparato per la prima volta nel 1954 da Haszeldine e Kidd tramite la procedura schematizzata nella figura seguente:[3]
Sintesi
Industrialmente l'acido triflico si produce per fluorurazione elettrochimica (ECF) dell'acido metansolfonico:
Il CF3SO2F formato viene idrolizzato, e il sale triflato risultante viene protonato. In alternativa, l'acido triflico si ottiene per ossidazione di CF3SCl:[4]
L'acido triflico è purificato per distillazione dall'anidride triflica.[2]
Reattività
L'acido triflico in condizioni normali è un liquido incolore igroscopico, di odore pungente. Fuma all'aria e in presenza di umidità forma un monoidrato stabile, CF3SO3H·H2O, che ha un punto di fusione di 34 °C. Oltre che in acqua, l'acido triflico si scioglie in solventi polari come DMF, DMSO, acetonitrile e dimetilsolfone. L'aggiunta di acido triflico a solventi polari può essere pericolosamente esotermica.
L'acido triflico ha Ka = 8,0 × 1014 e di conseguenza è considerato un superacido. È un composto molto utile in virtù della sua elevata stabilità termica e chimica. Sia l'acido che la sua base coniugata CF3-SO3– (ione triflato, OTf–) sono molto resistenti a processi di ossidoriduzione, mentre altri acidi forti come HClO4 e HNO3 sono ossidanti. Un altro vantaggio dell'acido triflico è che non dà reazioni di solfonazione, come possono invece fare altri acidi forti come l'acido solforico stesso (H2SO4), l'acido fluorosolforico (F-SO3H) e l'acido clorosolforico (Cl-SO3H).
Usi
In laboratorio l'acido triflico è utile per reazioni di protonazione perché la sua base coniugata non è nucleofila. Viene utilizzato anche come titolante in titolazioni acido-base in ambienti non acquosi perché si comporta da acido forte in molti solventi (acetonitrile, acido acetico ecc.) dove i comuni acidi minerali come HCl e H2SO4 sono di forza moderata.
Formazione di sali
HOTf reagisce esotermicamente con carbonati e idrossidi dei metalli. Un esempio è la sintesi di Cu(OTf)2:[5]
Leganti cloruro possono essere convertiti nei corrispondenti triflati:
Questa conversione è effettuata in acido triflico puro a 100 °C, facendo poi precipitare il sale per aggiunta di etere.
Reazioni organiche[1]
L'acido triflico reagisce con alogenuri acilici per formare anidridi miste triflate, che sono forti agenti acilanti, ad esempio in reazioni di Friedel-Crafts.
L'acido triflico catalizza la reazione di composti aromatici con cloruri solfonilici R-S(=O)2-Cl; probabilmente un intermedio è l'anidride mista dell'acido solfonico.
L'acido triflico catalizza altre reazioni di tipo Friedel-Crafts, come il cracking di alcani e l'alchilazione di alcheni, reazioni molto importanti nell'industria petrolifera. Questi catalizzatori derivati dall'acido triflico sono molto efficienti per l'isomerizzazione di idrocarburi a catena lineare o leggermente ramificata, utile per aumentare il numero di ottano dei carburanti.
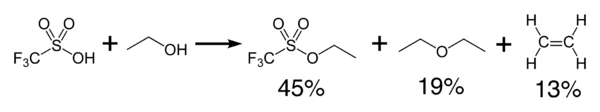
L'acido triflico reagisce esotermicamente con alcoli per formare eteri e olefine:
Indicazioni di sicurezza
L'acido trifluorometansolfonico è disponibile in commercio. È un liquido tossico per inalazione e nocivo per ingestione. Per contatto provoca gravi ustioni a pelle, mucose e occhi. Non ci sono dati che indichino proprietà cancerogene. È considerato poco pericoloso per le acque e gli organismi acquatici.[6]
Note
- ^ a b Howells e Mc Cown 1977.
- ^ a b Subramanian et al. 2006.
- ^ Haszeldine e Kidd 1954.
- ^ Siegemund et al. 2007.
- ^ Dixon et al. 1990.
- ^ Alfa Aesar, Scheda dei dati di sicurezza dell'acido trifluorometansolfonico (PDF) [collegamento interrotto], su alfa.com. URL consultato il 27 febbraio 2012.
Bibliografia
- N. E. Dixon, G. A. Lawrance, P. A. Lay, A. M. Sargeson e H. Taube, Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes, in Inorg. Synth., vol. 28, 1990, pp. 70–76, DOI:10.1002/9780470132593.ch16. URL consultato il 27 febbraio 2012.
- R. N. Haszeldine e J. M. Kidd, Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid, in J. Chem. Soc., 1954, pp. 4228-4232, DOI:10.1039/JR9540004228. URL consultato il 27 febbraio 2012.
- R. D. Howells e J. D. Mc Cown, Trifluoromethanesulfonic acid and derivatives, in Chem. Rev., vol. 77, n. 1, 1977, pp. 69–92, DOI:10.1021/cr60305a005. URL consultato il 27 febbraio 2012.
- G. Siegemund, W. Schwertfeger, A. Feiring, B. Smart, F. Behr, H. Vogel e B. McKusick, Fluorine Compounds, Organic, in Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, 2007, DOI:10.1002/14356007.a11_349.
- L. R. Subramanian, A. G. Martínez, M. Hanack, G. K. S. Prakash e J. Hu, Trifluoromethanesulfonic Acid, in e-EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2006, DOI:10.1002/047084289X.rt246.pub2.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su acido trifluorometansolfonico
Wikimedia Commons contiene immagini o altri file su acido trifluorometansolfonico
V · D · M | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fluoruri inorganici |
| ||||||||||||||||
| Organofluoruri | Aloperidolo · Bicalutamide · Desflurano · Desossimetasone · 1,2-dicloro-1,2-difluoroetene · Diclorodifluorometano · 1,2-diclorotetrafluoroetano · 1,2-dicloro-1-(trifluorometossi)-1,2,2-trifluoroetano · 1,1-difluoro-1-cloro-etano · Difluprednato · Doxefazepam · Droperidolo · Eptafluoropropano · Esafluoro-1,3-butadiene · Esafluoro-2-propanolo · FGIN-127 · Fipronil · 1-fluoro-2,4-dinitrobenzene · Fluorobenzene · Fluorofosgene · Fluorometano · Fluoruro di vinilidene · Fluoximesterone · Flupirtina · Lufenuron · Metossiflurano · Monoclorodifluorometano · Niaprazina · Nitisinone · Perfluoropropene · Perfluoroesano · Perfluoroisobutene · Perfluorononanoato di ammonio · Piriprolo · Riluzolo · Ritanserina · Seletracetam · Tegafur · Telcagepant · 1,2,3,4-tetracloro-esafluorobutano · 1,1,1,2-tetrafluoroetano · Tetrafluoroetene · Tetrafluorometano · Travoprost · 1,1,2-tricloro-1-fluoroetano · Triclorofluorometano · 1,1,2-triclorotrifluoroetano · 2-cloro-1,1,1-trifluoroetano · Trifluorometano · 2,4,6-tris(perfluorofenil)-1,3,5-triazina · Zolazepam | ||||||||||||||||
| Classi di fluoruri | Fluorocarburi · Idrofluoroeteri · Interalogeni | ||||||||||||||||
| Processi di sintesi | Fluorurazione elettrochimica | ||||||||||||||||
| Miscele | Acido magico · R-410A | ||||||||||||||||
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia



![{\displaystyle {\ce {3CF3SO3H + [Co(NH3)5Cl]Cl2 -> [Co(NH3)5O3SCF3](O3SCF3)2 + 3HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35eb904091a28877be08dfe30f00d1c30facea9)














