コバルトセン
| コバルトセン | |
|---|---|
 |  |
コバルトセン、 ビス(η5-シクロペンタジエニル)- | |
別称 Cp2Co | |
| 識別情報 | |
| CAS登録番号 | 1277-43-6 |
| RTECS番号 | GG0350000 |
| 特性 | |
| 化学式 | [Co(η5C5H5)2] |
| モル質量 | 189.12 g/mol |
| 水への溶解度 | 不溶 |
| 構造 | |
| 配位構造 | サンドイッチ |
| 双極子モーメント | zero |
| 熱化学 | |
| 標準生成熱 ΔfH | +236.9 kJ/mol[1] |
| 標準燃焼熱 ΔcH | -5839 kJ/mol[2] |
| 標準モルエントロピー S | 236.1 J K−1mol−1[1] |
| 危険性 | |
| EU分類 | 記載無し |
| 関連する物質 | |
| 関連するメタロセン | フェロセン ニッケロセン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
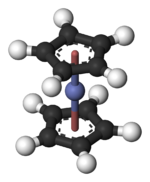
コバルトセン(Cobaltocene)または、ビス(シクロペンタジエニル)コバルト(II)(bis(cyclopentadienyl)cobalt(II)、bis Cp cobalt)は、化学式がCo(η5C5H5)2の有機金属化合物である。常温で暗紫色の固体で、真空中では40℃で昇華する。空気中の酸素と反応しやすいため、空気を絶って保存しなければならない。
合成
コバルトセンはTHF中でシクロペンタジエニドナトリウムと無水塩化コバルト(II)とを反応させて合成された。副生成物として塩化ナトリウムが生成するため、生成した有機金属化合物は昇華によって精製する[3]。
構造と結合
コバルトセンは、金属原子がシクロペンタジエニル環(Cp)にサンドイッチされたメタロセンと呼ばれる有機金属化合物に分類される[4]。メタロセンはサンドイッチ化合物に属する。
コバルトセンは19の価電子を持ち、これは有効原子番号則を満たす非常に安定な類縁体であるフェロセンよりも1つ多い。この付加された電子はCo-C結合に対し反結合性軌道を占有している。したがって、Co-C結合はフェロセンのFe-C結合よりやや長い。コバルトセンはその「余分な」電子を失う特徴的な化学反応をし、コバルトセニウムという18電子カチオンを作る。
酸化還元挙動
コバルトセンは実験室において、1電子還元剤として用いられる[5]。実際には、コバルトセンの可逆的なレドックスカップルは、その振る舞いからサイクリックボルタンメトリーの内部標準に使われている。類似化合物の1つ、化学式がCo(C5Me5)2 のデカメチルコバルトセンは、電子供与性基であるメチル基を10個持つため際だって強力な還元剤である。これら2つの化合物は無極性の有機溶媒に溶解する珍しい還元剤の例である。これらの化合物の還元力は以下の通りである。
このデータから、デカメチル化合物は元のメタロセンに比べて約600mV還元されていることが分かる。しかし、置換基による効果は、鉄からコバルトに変えることによって1.3V以上変化するように、金属の影響によって覆い隠される。
その他反応
コバルトセンを一酸化炭素で処理するとCp配位子を1つ失ってコバルト(I)の誘導体であるCo(C5H5)(CO)2を与える。この化合物は空気に対し安定で、また、蒸留可能な液体であり、「2本の脚を持つピアノ椅子構造」をとる。
脚注
- ^ a b 『化学便覧 基礎編』 II、日本化学会 編(改訂6版)、丸善出版、2021年。ISBN 978-4-621-30521-8。 表10.10-12.
- ^ “Cobaltocene”. NIST. 2021年3月8日閲覧。
- ^ King, R. B. “Organometallic Syntheses” Volume 1: Academic Press: New York, 1965.
- ^ C. Elschenbroich, A. Salzer ”Organometallics : A Concise Introduction” (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ Connelly, N. G. and Geiger, W. E., "Chemical Redox Agents for Organometallic Chemistry", Chemical Reviews, 1996, volume 96, 877-922
外部リンク
- IARC Monograph "Cobalt and Cobalt Compounds"
- National Pollutant Inventory - Cobalt fact sheet
- NIST Standard Reference Database

![{\displaystyle {\ce {2[Co(C5H5)2]+\ + 2I^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26378641550437d85e9487006456290a00d157c5)















