炭酸バリウム
| 炭酸バリウム | |
|---|---|
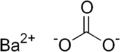 | |
 | |
別称 毒重石 | |
| 識別情報 | |
| CAS登録番号 | 513-77-9  |
| ChemSpider | 10121  |
| UNII | 6P669D8HQ8  |
| EC番号 | 208-167-3 |
| 国連/北米番号 | 1564 |
| RTECS番号 | CQ8600000 |
| |
| |
| 特性 | |
| 化学式 | BaCO3 |
| モル質量 | 197.34 g/mol |
| 外観 | white crystals |
| 密度 | 4.286 g/cm3 |
| 融点 | 811 °C |
| 沸点 | 1360 °C (分解) |
| 水への溶解度 | 0.0024 g/100 mL (20 °C) |
| 溶解度 | 塩酸、硝酸、エタノールに溶ける 硫酸に溶けない |
| 屈折率 (nD) | 1.60 |
| 熱化学 | |
| 標準生成熱 ΔfH | −1219 kJ·mol−1[1] |
| 標準モルエントロピー S | 112 J·mol−1·K−1[1] |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0777 |
| EU分類 | Harmful (Xn) |
| EU Index | 056-003-00-2 |
| NFPA 704 |  0 2 0 |
| Rフレーズ | R22 |
| Sフレーズ | (S2), S24/25 |
| 半数致死量 LD50 | 418 mg/kg, 経口 (ラット) |
| 関連する物質 | |
| その他の陽イオン | 炭酸マグネシウム 炭酸カルシウム 炭酸ストロンチウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
炭酸バリウム(たんさんバリウム、barium carbonate)は、バリウムの炭酸塩で、化学式 BaCO3 で表される無機化合物である。
天然には石灰岩質の堆積層の中に形成された熱水鉱床の中に産出することがあり、鉱物名は毒重石(witherite)と呼ばれる。
毒重石の結晶構造は直方晶系である。結晶は常に3つのグループがそれぞれ対になっており、石英の二錐体結晶に似た擬似六方晶を生じ、その面は通常粗く、水平方向に筋状になっている[2][5]。毒重石は、1084Kで六方晶相に、1254Kで立方晶相に相転移する。
この鉱物は、1784年に毒重石は重晶石とは化学的に異なることを発見したウィリアム・ウィザリングにちなんで名づけられた[3]。毒重石は、硫酸カルシウムを含む水の作用で硫酸バリウムに変化しやすく、故に結晶の表面は重晶石で覆われていることが多い。殺鼠剤の調製、ガラスや磁器の製造に使用されており、かつては砂糖の精製に使用されていた[2] 。
性質
炭酸イオンを含む水溶液に、塩化バリウム(BaCl2)の水溶液を加えると、難溶性の白色沈殿として生成する。
工業的には天然の硫酸バリウムである重晶石に炭素としての石炭かコークスを加えて還元焙焼して硫化バリウムを得た後、これを炭酸ナトリウム(ソーダ灰)の水溶液の中で反応させる方法が用いられている。
塩酸(HClaq)に溶け、バリウムイオンを含む水溶液になる(下式)。そのため、硫酸バリウムと間違えてX線撮影の造影剤に使うと、胃酸(主に塩酸)に溶けて有毒なバリウムイオンを生じるため危険である。天然鉱物として産出する毒重石の名称は、これに由来する。
用途
フェライト磁石製造、釉薬、顔料、金属の熱処理、染料など。バリウムのX線を遮蔽する性質を利用して、ブラウン管ガラスの添加剤としても多く使用されたが、この用途は需要がほとんどなくなっている。
一般的にバリウムの原料としては重晶石が用いられる。しかし、イギリスでは毒重石が多く産出したため、こちらをバリウムの原料として利用する事があった。
法規制
日本では毒物及び劇物取締法および毒物及び劇物指定令によりバリウム化合物として劇物に指定されている。 他に、消防法、労働安全衛生法、大気汚染防止法、船舶安全法、航空法にも規定がある。
出典
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. ISBN 061894690X
- ^ a b Encyclopædia Britannica (11 ed.). Cambridge University Press. (1911). p. 759
- ^ Withering William (1784). Experiments and Observations on Terra Poderosa. Philosophical Transactions of the Royal Society of London. pp. 293-311. doi:10.1098/rstl.1784.0024
- 蝶理
バリウムの化合物 | |
|---|---|
| 二元化合物 | |
| 三元化合物 |
|
| |
- 表示
- 編集









