三重水素
| 三重水素 | |
|---|---|
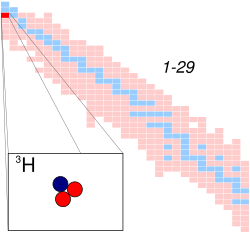 核種の一覧における三重水素の位置 | |
| 概要 | |
| 名称、記号 | トリチウム,3H |
| 中性子 | 2 |
| 陽子 | 1 |
| 核種情報 | |
| 天然存在比 | 10-18[1] |
| 半減期 | 12.32 年 |
| 崩壊生成物 | 3He |
| 同位体質量 | 3.0160492 u |
| スピン角運動量 | 1/2+ |
| 余剰エネルギー | 14,949.794± 0.001 keV |
| 結合エネルギー | 8,481.821± 0.004 keV |
| ベータ崩壊 | 0.018590 MeV |
三重水素(さんじゅうすいそ)またはトリチウム(英: tritium、記号: T)は、質量数が3である水素の同位体、すなわち陽子1つと中性子2つから構成される核種であり、半減期12.32年で3Heへとβ崩壊する放射性同位体である。三重水素は、宇宙線と大気との相互作用により、地球全体で年間約72 PBq(7.2京ベクレル[注 1])ほど天然に生成されている[2]。
重水素(2H)と三重水素(3H)とを併せて重水素(heavy hydrogen)と呼ばれることがある。三重水素核は三重陽子 (英: triton) とも呼ばれる。
三重水素は、その質量が軽水素の約3倍、二重水素の約1.5倍と差が大きいことから、物理的性質も大きく異なる。一方、化学的性質は最外殻電子の数(水素の場合は1)によって決まる要素が大きいため、三重水素の化学的性質は軽水素や重水素とほぼ同じであることが多い。同位体効果の項も参照。
概要
自然界に最も普遍的に存在する水素は、原子核が単独の陽子から成る軽水素(1H)である。原子核が陽子1つと中性子1つから成る重水素(2H)も、安定核のため比較的豊富に存在する (自然界の水素同位体の0.0115%[注 2][3]) のに対し、三重水素は不安定[注 3]なため天然には微量しか存在しない。とはいえ、宇宙線により生成され続けているため、天然においても一定量が常に存在している。たとえば体重60 kg程度の人の場合、50ベクレル程度のトリチウムを体内に保有している[4]。水素には質量数が4から7の同位体もあるが、いずれも半減期が10-22秒以下と極めて不安定である。
三重水素は、地球環境においては、酸素と結びついたトリチウム水(HTO[注 4])として水に混在しており[注 5]、水圏中に気相、液相、固相の形態で広く拡散分布している。大気中においては、トリチウム水蒸気(HTO)、トリチウム水素(HT)および炭化トリチウム(CH3T)の3つの化学形で、それぞれ水蒸気、水素、炭化水素と混在している。なお、海水中の三重水素濃度は通常、数 Bq/Lより少ない[注 6][注 7]。
三重水素は、宇宙線と大気の相互作用により、地球全体で年間約72 PBq(7.2京ベクレル[注 8])ほど天然に生成される[2]。加えて、過去の核実験により環境中に大量に放出され[注 9]、未だに残っている三重水素(フォールアウト・トリチウム)、原子力発電所または核燃料再処理施設などの原子炉関連施設から大気圏や海洋へ計画放出された三重水素(施設起源トリチウム)[注 10]が地球上で観測される三重水素の主たる起源である[9]。
高純度の液体トリチウムは、核融合反応のD-T反応を起こす上で必須の燃料であり、水素爆弾の原料の一つとしても利用される[10]。
体内では均等分布で、生物的半減期が短く、エネルギーも低い。こうしたことから三重水素は最も毒性の少ない放射性核種の1つと考えられ[11]、生物影響の面からは従来比較的軽視されてきた[12]。しかし一方で、三重水素を大量に取扱う製造の技術者の、内部被曝による致死例が2例報告されている[注 11]。三重水素の生物圏に与える影響については、環境放射能安全研究年次計画[13]において研究課題として取り上げられたことなどもあり、長期の研究実績に基づいた報告書が公表されている[14]。
名称
三重水素は歴史的経緯から固有の名称が与えられている。三重水素にはトリチウム(英: tritium、記号: T)という別名がつけられている。これはギリシャ語で「三番目」を意味するτρίτος(trítosトリトス)に由来する。T という記号は三重水素という水素の同位体に対して特別に割り当てられた記号である。このようにある元素の同位体に対して特別な記号が与えられているものとしては、他には二重水素に対する D やトロン(ラドン220)に対する Tn などがある。
トリチウムという別名には、幾つかの表記ゆれが存在する。例として、トリチュウム[15][16]、トリチューム[17][18]。
通常の元素の同位体の記号と同様に、元素記号の左肩に質量数を付与し、元素名の後に質量数を付与して水素3(すいそ-、英: hydrogen-3、記号: 3H)とすることもあるが、この名称及び表記はあまり使われない。
歴史
- 1929年、恒星のエネルギーが、核融合で供給されることが分かる。
- 1933年、レオ・シラードが原子爆弾(原爆)の理論的可能性を提起。
- 1934年、マーク・オリファントら、重水素核同士を衝突させ質量3のトリチウムを合成。
- 1934年、電気分解で得た重水中に天然由来のトリチウムを見出す。
- 1935年、1月、電解水素メーカーのNorsk hydro Enters社が重水の商業生産を開始。
- 1942年、アメリカのエドワード・テラーが水素爆弾(水爆)の理論的可能性を提起。
- 1945年、7月16日、アメリカのニューメキシコ州で初の原爆実験(トリニティ実験)。以後、原爆実験で5.55×1016 Bqのトリチウムが放出される。
- 1945年、カナダで減速材中にトリチウムが生成されるCANDU炉の開発始まる。
- 1949年、ドイツのV. Faltingsら、液体空気製造工場のヘリウム含有廃ガス中に環境トリチウムを発見。
- 1950年、1月31日、アメリカのトルーマン大統領が水爆の開発計画を表明。
- 1950年代、アメリカ・オークリッジでPUREX法(ピューレックス)による再処理技術が開発される。
- 1952年、11月1日、アメリカがエニウェトク環礁で液体トリチウムを原料とした初の水爆実験(アイビー作戦)。以後、水爆実験で2.4×1020Bqのトリチウムが放出される。
- 1953年、1月4日、ソ連のマヤーク核技術施設でトリチウム事故、2名が死亡。
- 1953年、8月12日、ソ連がブースト型核分裂兵器の実験を行う。
- 1954年、3月1日、アメリカがビキニ環礁でトリチウムを原料としないテラー・ウラム型水爆実験(キャッスル作戦)を実施。日本の漁船「第五福竜丸」等が被曝。
- 1961年、スイスでトリチウム事故。3名が被曝し、うち1名が死亡。
- 1963年、8月5日、部分的核実験禁止条約が調印され、大気圏内原水爆の実験が禁止される。
- 1964年、西ドイツでトリチウム事故。44名が被曝し、うち1名が死亡。
- 1970年、重水を減速材として使用する「ふげん」(福井県敦賀市)が着工。
- 1977年、イギリスでトリチウム事故。2名が被曝。
- 1978年、フランスにある世界最大のラ・アーグ再処理工場が運転開始。同工場は1×1016 Bq/年のトリチウムを海洋放出。
- 1981年、1月、動力炉・核燃料開発事業団東海事業所の再処理施設(茨城県東海村)が本格運転を開始。発生するトリチウムは希釈廃棄処分。
- 1993年、六ヶ所再処理工場(青森県六ヶ所村)の建設始まる。同工場は大気中および海中を合わせ、約2×1016 Bq/年のトリチウムを希釈廃棄処分する予定。
- 2002年、アメリカ合衆国のテネシー川流域開発公社運営のワッツバー原子力発電所(英語版)1号炉が稼働し、アメリカ合衆国エネルギー省(DOE)の国家核安全保障局(NNSA)の事業として、核爆弾用のトリチウムの生産を開始[19]。
- 2005年、ワッツバー原発1号炉のトリチウム製造ロッドが、政府核施設であるサバンナ・リバー・サイトに搬送される。
- 2011年3月11日、福島第一原子力発電所事故が発生、トリチウムも太平洋に漏出。
- 2016年2月、アメリカ合衆国ニューヨーク市から40 kmに位置するインディアンポイント原子力発電所(en:Indian Point Energy Center)で、トリチウムの漏出が見つかる。10月、ワッツバー原発の2号炉が稼働[19]。
- 2017年1月19日、インディアンポイント原子力発電所の閉鎖決定。
- 2023年8月24日、福島第一原発の廃炉作業で生成し続けるトリチウム入り処理水の海洋投棄を開始。中国が反発。
物理的特徴

三重水素は弱いβ線(18.6 keV 以下)を放射しながらβ崩壊を起こし、ヘリウム3 (3He) へと変わるベータ放射体(beta-emitter)で、半減期は12.32年である[20][21]。
電子は、 5.7 keV の平均運動エネルギーを持ち、残りのエネルギーは反電子ニュートリノによって奪われる。三重水素から発する低いエネルギーのβ線は人間の皮膚を貫通できず、外部被曝の危険性がほとんどないため、その酸化物であるトリチウム水(HTO)は放射性夜光塗料の材料などに用いられている[22][注 12]。また、この低いエネルギーであるがゆえに、三重水素の標識化合物は、液体シンチレーション計測法でないと検知することができない[注 13]。
熱核反応(核融合反応)の燃料として
二重水素(D)と三重水素(T)の核融合反応である熱核反応(D-T反応)は、二重水素同士の熱核反応(D-D反応)に比べて反応に必要な温度・圧力条件が低い。
そのため、1952年の核実験にてエニウェトク環礁の一つの小島を消滅させた水爆の原理の中では、D-D反応を起こすための中間の起爆反応として用いられた[23]。現在では、三重水素は、ITERをはじめとする核融合実験炉においては核燃料として研究されている。
トリチウムの生成
三重水素(トリチウム)は原子炉においては、炉内の重水(HDO)の二重水素(D)が中性子捕獲することでトリチウム水(HTO)の形で生成される。
ほかには、ウラン235 (235U) 或いはプルトニウム239 (239Pu) が中性子と反応した時に起こる三体核分裂によっても生じる。また、制御棒に使用されるホウ素同位体 10B が、高速中性子を捕獲することでも生じる。
生成量は原子炉ごとに異なるとされるが、一年間の運転で加圧水型軽水炉内には約200兆ベクレル (2×1014 Bq)、沸騰水型軽水炉では約20兆ベクレル (2×1013 Bq) が蓄積する[24]。しかしながら、トリチウム水(HTO)は、化学的性質が水(H2O, HHO)とほぼ同一であるため、化学的には水とトリチウム水を分離することはできない[注 14]。ただし物理的な同位体効果を利用した分離技術は確立されており[注 15]、トリチウム含有水の蒸留や電気分解、同位体交換法など、いくつか分離方法が存在する[26][27]。しかしそれでも大量かつ極めて低濃度の水からトリチウム水だけ、分離してまとまった量を回収することはコスト的に非常に困難である[注 16][注 17]。
トリチウム水からトリチウムを単離するのは上述のとおり極めて難しいため、高い純度のトリチウムを得るにあたっては回収しやすい形で人工的に生成する必要がある。比較的良く知られたトリチウムの生成方法としては、原子炉内でリチウム Li に中性子を当て(中性子捕獲させ)、トリチウムとヘリウム4 (4He) に分裂させた上で得るという方法がある[28][注 18]。しかし、リチウムはイオン化傾向が高く、少量の水と接触するだけで激しく反応するなどの性質があり危険であるため、反応性はなくすがリチウムのトリチウムにはなる性質は残す合金を作るといった研究が行われている。東京工業大学でリチウムと鉛の合金が適しているといった研究結果が出されている。また、この合金だと鉛に当たった中性子は2倍に増えるため、通常より多くのトリチウムが生産されることも期待されている。
ただし、この方法の場合、十分な量のトリチウムを生成するためには中性子がその分相当量必要となり、やはりトリチウムの価格がデューテリウム(二重水素)に比べて高くなる[注 19]。
自然界での生成
宇宙線の中性子または陽子が大気中の窒素または酸素と核反応し、地表の単位面積あたり毎秒0.2 個程度 (= ~0.2 /cm2⋅sec) の割合で三重水素が生成している。地球の表面積を 5.1×1014 m2 とすると、トリチウムの年間生成量は約72 PBq (= ~72×1015 Bq)となる[2]。放射性崩壊と天然生成量が平衡にある時、その同位対比は地表に存在する水素原子の 10−18 に相当し、これを1 TU (Tritium Unit) と定めている。
製造
1996年のエネルギー・環境研究所(Institute for Energy and Environmental Research)によるアメリカ合衆国エネルギー省に関する報告書によると米国の核兵器用トリチウムはサバンナ・リバー・サイトで製造され、1955年の操業開始から1988年の施設閉鎖までに225 kgが生産され、1996年時点で約75 kgが残った。 商用のトリチウムはカナダのCANDU型原子炉の重水素減速材中で生成するトリチウムを使用している。カナダ・オンタリオ州にある重水からトリチウムを除去する施設では年間2500トンまで重水を処理でき、約2.5 kgのトリチウムを分離してこれを販売している[30]。
用途

トリチウムは1グラムあたり300万円(2004年)と高価なため、これに見合う用途に限られる。
- 原子爆弾の出力増強剤(ブースト型核分裂兵器)
- 原子爆弾のエネルギ―を重水素-トリチウム水素の混合ガスに照射してD-T反応を起こし、それで生じた中性子で核分裂反応を促進し核爆弾の威力を増強したもの。爆弾1個当たり2 g程度のトリチウムを使用し、壊変で消滅して失われる分を補給するため8年に1回トリチウムガスを交換する。また、アイビー作戦マイク実験においては、核融合装置(水素爆弾)内の液体重水素を核融合反応させるために、テラー・ウラム型デザインの一環として、セカンダリーにトリチウムとプルトニウム製のスパーク・プラグが用いられた。
- 中性子爆弾原料
- ブースト型と同様にD-T反応を利用した爆弾で、爆発の威力を増強せず、中性子の放出を増加させることを目指している。中性子は質量がほぼ等しい水素との相互作用が大きい。この性質を利用し水素原子を多く含む生体を殺傷し、建物などを破壊しない兵器として開発された。
- 核融合炉燃料
- 核融合炉の一種で実用化に最も近い重水素とトリチウム核が融合するD-T反応で生じるエネルギーを利用するトカマク型炉で使われる。
- 本炉では点火時に約3 kg程度のトリチウムの使用が予定され、これはCANDU炉から供給することを予定している。
- 同様にレーザー核融合用燃料ペレットに核燃料として重水素と共に封入されている事が多く、実用発電炉では重水素と三重水素混合超低温固体燃料を使う事も構想されている。
- 生体試験用トレーサー/オートラジオグラフィー用試薬
- 生体分子の元素の一部を検出感度の高い放射性物質に置き換えた化合物で生体中のその分子の移動を求めるのがトレーサー法で分子の2次元画像で集積位置を求めるのがオートラジオグラフィー法である。対象が有機物質の場合、放射性物質として14Cを使う方法とトリチウムを使う方法があるが比放射能高いトリチウムが多く用いられる。
- またトリチウムが放出するβ線の飛程が短い事から分解能の高い画像が得られる。用途にチミジンがDNA合成量、ウリジルがRNA合成量の定量に使用される。またチミジンが細胞のDNA合成期である細胞周期のS期に取り込まれることを利用した研究が行われている。
- トリチウムライト
- トリチウムが放出するβ線を蛍光物質にあてて発光させるライトで腕時計の文字盤や銃器の暗視スコープなどに使用されている。また小銃などに用いられるドットサイトの光源として使われる例もある。
- 電池
- トリチウムライトの光を太陽電池素子に照射することで電気を作る原子力電池の一種。
- 年代測定
- 雨水中のトリチウムの初期濃度Coと地下水の採取位置での濃度Ctならびにトリチウムの半減期に 年数=半減期・log[Co/Ct]/log(2) という関係がある、これより地下水の年代が求められる。富士山の湧き水の年代などが測定されている。
トリチウム水の環境への放出
脚注
注釈
- ^ 1 PBq(1ペタベクレル)=1015 Bq(1千兆ベクレル)
- ^ 温帯地方の天然水における割合。不確かさは±0.0070%。
- ^ 半減期12.32年
- ^ 水分子は水素原子2個と酸素原子1個からなることから、その化学式は良く知られているように、 である。これを全原子を明示する形に冗長に書けば、となる。地球上に存在する大半の水素と酸素の質量数はそれぞれ1と16であるので、質量数を明示する形でさらに冗長に書けば、となる。ところで、トリチウム水とは水分子の一つ(または二つのこともあるかもしれないが今は考えない)の水素が3倍の重さの三重水素に置き換わったものであった。したがって、トリチウム水であれば水分子の式は、と書ける。さらに、三重水素 には特別な略記号が与えられていた。すなわち、は単純にに置き換えて良い。したがって、と書ける。ここで最後に、左肩の質量数の添字を省略すれば、トリチウム水を表す水分子の式は、となることがわかる。
- ^ トリチウム水 HTO は、天然存在濃度では、軽水( H2O)と性質や反応にほとんど違いがなく、水の理想的なトレーサーとしての利用がある。宇宙線の作用による生成速度を一定とみなせば、放射性壊変による消失速度が一定であるので、地球における天然の三重水素総量は古今とも一定値となる。地球上での分布としては水素ガス中のトリチウム(HT)は大気上層から下層まで均一であるが、水蒸気中のトリチウム(HTO)は上層ほど増大している[5][6]。大気循環しているトリチウム水濃度は、おおまかに地球上で動植物も含め一定値と考え、水中濃度の低下量から大気循環から外れた期間を知る地下水の年代測定が可能である。土木、農業分野での地下水流動の実証的な調査に役立てられている。
- ^ 日本国内で測定された最高値は、原発事故を起こした福島第一原発の港湾内2・3号機取水口間にて2014年5月12日に採取した海水から1900 Bq/L検出されている[7]。他の原発の例では、1991年2月9日に美浜原発の放射能漏れ事故の際に、福井県美浜町沖の海水で、1991年2月18日に測定された490 Bq/Lであった。また、東海再処理施設の排水の影響により、茨城県東海村沖で、1990年1月1日に190 Bq/Lの三重水素が海水から検出されている。
- ^ 日本国内の環境中における三重水素濃度は、文部科学省の委託で日本分析センターが環境放射線データベースを公開している。世界の環境水中の三重水素濃度は、国際原子力機関(IAEA)がGNIPデータベース(Global Network for Isotopes in Precipitation)として公開している。また、放射線医学総合研究所のGNIPデータベース用の測定データも環境中のトリチウム測定調査データベースNETS DBで利用申し込みにより無料で検索できる。
- ^ 1 PBq(1ペタベクレル)=1015 Bq(1千兆ベクレル)
- ^ 核兵器(分裂と融合)の大気圏内核実験により環境中の濃度は、それ以前の天然存在量の200倍程度へと急増したが、環境中への放出量の減少により漸減している[8]。
- ^ なお、再処理施設からの放出実績および基準については、表2 再処理施設からの放射性気体廃棄物の年間放出実績(1977年度〜1996年度)および表3 東海再処理施設保安規定に定める処理済廃液の放出基準および1年間の最大放出量(ATOMICA:再処理施設からの放射性廃棄物の処理内図表)参照
- ^ 詳細は、(松岡 1995, pp. 9f.) 参照。なお、その事例の報告を受け国際放射線防護委員会(ICRP)の安全基準は改訂されている。同書より。
- ^ またトリチウム水は、分子生物学の実験などにおける、放射性同位元素標識にも利用される。
- ^ 一般環境中の濃度は 1–3 Bq/L 程度と低いため、特別にバックグラウンドノイズを軽減した液体シンチレーションカウンターが必須である。なお、かつてはガスカウンターが用いられた[8]。別な方法としては、崩壊で生じる 3He を質量分析装置で計測する方法もあるが、数ヶ月の期間が必要である。トリチウム 原子力資料情報室(CNIC)
- ^ 一般的な溶媒である水そのものであるため、化学反応により溶媒に不溶性の化合物を作り沈殿させ、それをろ過するという手法などが使えない。
- ^ 水素は同位体の質量比がすべての元素の中で最も大きく、同位体分離が一番容易であると言われる[25]。
- ^ 現在もっとも多くのトリチウムを生成している施設は原子炉の一種であるCANDU炉である。CANDU炉では重水を冷却と減速材に使用するため、重水中の重水素が中性子を吸収することにより生じる。トリチウムの回収はCANDU炉使用の上で重大な問題であり、回収されたトリチウムは科学的、あるいはその他の目的に使用されるが、一部は環境中に放出される。実際、カナダのブルース原子力発電所や韓国の月城原子力発電所周辺では環境中トリチウム濃度の増加が観測されている。
- ^ 膨大な汚染水から低濃度のトリチウムを分離するのは溶媒が水であるがために難しく、原子力施設から環境中に放出されたトリチウムは2015年現在の技術では除染できない核種である。 「福島第一原子力発電所事故#ALPS」も参照
- ^ ほか、工藤 (1985) に詳しい
- ^ 本来、原子炉内で核分裂に寄与しない中性子は、燃料棒などに含まれるウラン238をプルトニウム239に核変換させるために利用させるため、この方法ではプルトニウムを作る代わりにトリチウムを作るということになり、プルトニウム価格に応じて高くなる [29]。
出典
- ^ "Tritium". Encyclopedia Britannica. Britannica. 2021年4月15日閲覧。
- ^ a b c 宇田 & 田中 2009.
- ^ “「原子量表(2012)」について”. 日本化学会 原子量専門委員会. 2021年4月14日閲覧。
- ^ “よくあるご質問(FAQ)”. 核融合科学研究所. 2019年9月16日閲覧。
- ^ Allen S. Mason, H. Göte Östlund (1976-10-20). “Atmospheric HT and HTO: 3. Vertical transport of water in the stratosphere”. Journal of Geophysical Research. doi:10.1029/JC081i030p05349. https://doi.org/10.1029/JC081i030p05349.
- ^ 神山孝吉, 渡辺興亜「南極内陸氷床上へ降下・堆積する物質について」『南極資料』第38巻第3号、1994年11月、232-242頁、doi:10.15094/00008863、ISSN 0085-7289、NAID 120005509802。
- ^ 放射能濃度、5カ所で最高値=福島第1港湾内外の海水—東電 2014年 5月 16日 20:30 JST 更新 ウォールストリートジャーナル
- ^ a b 百島 2000.
- ^ 宮本 2008.
- ^ 武谷 1957, p. 194.
- ^ 松岡 1995, pp. 9f.
- ^ 須山 & 江藤 1981.
- ^ 環境放射能安全研究年次計画
- ^ 放射線医学総合研究所 1978、放射線医学総合研究所 1986、放射線医学総合研究所 1999
- ^ 柴崎達雄, 畑中春夫, 松本勝利, 松尾孝治, 佐藤和志, 田中邦也「被圧水のかん養機構を考察するにあたっての混合トリチュウム濃度の意義」『日本地質学会学術大会講演要旨』第77年学術大会(1970静岡)、日本地質学会、1970年、155頁、doi:10.14863/geosocabst.1970.0_155、ISSN 1348-3935、NAID 110003036148。
- ^ 吉田平太郎「耐熱金属材料の水素透過」『防食技術』第33巻第7号、腐食防食協会、1984年、409-416頁、ISSN 0010-9355、NAID 130004731692。
- ^ 渡辺興亜「回想「広域積雪化学観測の道筋」」『雪氷』第62巻第3号、日本雪氷学会、2000年5月、279-285頁、doi:10.5331/seppyo.62.279、ISSN 03731006、NAID 10004644878。
- ^ 木村修一「血液から加齢制御を考える」『学苑』第830号、昭和女子大学近代文化研究所、2009年12月、1-10頁、ISSN 13480103、NAID 110007409721。
- ^ a b 日テレ 2022.
- ^ 井上 1989.
- ^ 国立天文台 2012.
- ^ 松岡 1995, pp. 13f.
- ^ 武谷 1957, pp. 194–197.
- ^ トリチウム 原子力資料情報室(CNIC)
- ^ 日本原子力学会 2014, p. 29.
- ^ 日本原子力学会 2014, pp. 29–38.
- ^ 磯村 1981.
- ^ 武谷 1957, pp. 194f.
- ^ 武谷 1968, pp. 281–285.
- ^ Whitlock, Jeremy. “Section D: Safety and Liability – How does Ontario Power Generation manage tritium production in its CANDU moderators?”. Canadian Nuclear FAQ. Dr. Jeremy Whitlock. 2010年9月19日閲覧。
参考文献
- 全般
- 中部電力, トリチウム, http://www.chuden.co.jp/resource/energy/hama_haikibutsu_tritium_1.pdf
- 磯村昌平 (1981), “重水素およびトリチウム分離技術の現状”, 日本原子力学会誌 23 (7): 483-488, https://doi.org/10.3327/jaesj.23.483
- 宮本霧子 (2008), “環境水の中のトリチウム”, 海生研ニュース, http://www.kaiseiken.or.jp/study/lib/news99_02.pdf
- 日本原子力学会, ed. (2014), トリチウム研究会 資料, http://fukushima.jaea.go.jp/initiatives/cat05/pdf/20140311.pdf
- 宇田達彦, 田中将裕「環境トリチウムの現状と分布(小特集 施設起源トリチウムの移行モデルと環境トリチウム分布)」『プラズマ・核融合学会誌』第85巻第7号、プラズマ・核融合学会、2009年7月、423-436頁、ISSN 09187928、NAID 40016770839。
- 百島則幸「解説 トリチウムの環境動態」『富山大学水素同位体科学研究センター研究報告』第20巻、富山大学水素同位体科学研究センター、2000年、1-10頁、doi:10.15099/00006454、ISSN 13463675、NAID 110000094733。
- 核融合・水素爆弾について
- 工藤博司「核融合炉燃料トリチウムの製造と化学」『RADIOISOTOPES』第34巻第8号、日本アイソトープ協会、1985年、432-441頁、doi:10.3769/radioisotopes.34.8_432、ISSN 0033-8303、NAID 130004381851。
- 武谷三男『原水爆実験』岩波書店〈岩波新書〉、1957年。
- 武谷三男『戦争と科学』 3巻〈武谷三男著作集〉、1968年11月。
- 日テレ (2022), 核戦争のリスク高まる中、かつての“秘密の町”は・・・核兵器の材料「トリチウム」増産の動きも, https://news.ntv.co.jp/category/international/eb9383c62e8148459aba0c467b00f2ec
- 生物影響について
- 山口武雄「トリチウムの生物影響」『日本原子力学会誌』第25巻第11号、日本原子力学会、1983年、895-900頁、doi:10.3327/jaesj.25.895、ISSN 0004-7120、NAID 130003746786。
- 須山一兵、江藤久美「水生生物に対するトリチウム水の影響」『日本原子力学会誌』第23巻第8号、日本原子力学会、1981年、564-570頁、doi:10.3327/jaesj.23.564、ISSN 0004-7120、NAID 130003746704。
- 松岡理『放射性物質の人体摂取障害の記録』日刊工業新聞社、1995年。ISBN 4526037796。
- 放射線医学総合研究所 (1978), 特別研究「環境放射線による被曝線量の推定に関する調査研究」 (最終報告書 ed.), https://iss.ndl.go.jp/books/R100000074-I000593246-00
- 放射線医学総合研究所 (1986), 特別研究「核融合炉開発に伴うトリチウムの生物学的影響に関する調査研究」 (最終報告書 ed.), https://www.nirs.qst.go.jp/publication/irregular/pdf/nirs_r_14.pdf
- 放射線医学総合研究所 (1999), 特別研究「環境における放射性物質の動態と被ばく線量算定に関する調査研究」 (最終報告書 ed.), https://www.nirs.qst.go.jp/publication/irregular/pdf/nirs_r_36.pdf
- その他
- 『トリチウム分析法』文部科学省科学技術・学術政策局原子力安全課防災環境対策室〈放射能測定法シリーズ〉、2002年。 NCID BA63862953。国立国会図書館書誌ID:000003582351。https://www.kankyo-hoshano.go.jp/wp-content/uploads/2020/12/No9.pdf。
- 原子力安全基盤機構企画部技術情報統括室 編『原子力施設運転管理年報』 平成23年版(平成22年実績)、2011年。ISSN 1347-0493。http://www.inaco.co.jp/isaac/shiryo/pdf/genpatu/jnes_23.pdf。
関連項目

外部リンク
- トリチウムの環境動態と人体影響 - 核融合科学研究会委託研究報告書から 大阪大学 齋藤眞弘(2003年)
- 水素同位体科学研究センター
- トリチウムの基本Q&A - 電気新聞
![{\displaystyle {}_{1}^{3}{\hbox{H}}\ {\xrightarrow[{12.32\,{\text{years}}}]{\beta ^{-}\ 18.6\,{\text{keV}}}}\ {}_{2}^{3}{\hbox{He}}+{\hbox{e}}^{-}+{\overline {\nu }}_{\hbox{e}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5fdf402e92bd00106b34bf1008735fd1b11dbaf)





















